Fosfà (grup)
Un fosfà és un compost químic molecular amb àtoms de fòsfor i d'hidrogen, un hidrur de fòsfor trivalent amb les fórmules generals amb si són lineals, amb si són monocíclics i amb i si són policíclics. Els membres individuals que tenen una cadena de fòsfor no ramificada s'anomenen fosfà , difosfà , trifosfà , etc.
Història

El fosfà fou sintetitzat per primera vegada el 1783 pel químic francès Philippe Gengembre (1764–1838), alumne d'Antoine L. Lavoisier. Gengembre comunicà la preparació d'un gas que s'inflamava de forma espontània escalfant fòsfor amb hidròxid de potassi,[1] segons la reacció representada per:El 1844, el químic francès Paul Thénard (1819–1884), fill del també químic francès Louis-Jacques Thénard (1777–1857), utilitzà una trampa freda per separar el difosfà del fosfà que s'havia generat a partir del fosfur de calci . Demostrà, així, que el és responsable de la inflamabilitat espontània associada al , i també del característic color taronja/marró que es pot formar a les superfícies, i que és un producte de polimerització.
Nomenclatura
La Unió Internacional de Química Pura i Aplicada (IUPAC) recomana emprar la nomenclatura substitutiva per anomenar els fosfans. En ella es fa servir el nom de l'hidrur més simple, l'anomenat hidrur progenitor o de referència, el fosfà , precedida per un prefix numèric (di-, tri-, tetra-, etc.) corresponent al nombre d'àtoms de fòsfor en la molècula. Així s'anomena com difosfà, és el tetrafosfà, etc. Si el compost forma un anell, s'ha d'emprar el prefix ciclo-, per exemple ciclopentafosfà .[2]
Malgrat que la IUPAC no ho recomana, permet que els fosfans siguin anomenats fent ús de la nomenclatura de composició, la usada comunament per anomenar composts químics inorgànics, així el fosfà pot anomenar-se trihidrur de fòsfor, el difosfà tetrahidrur de difòsfor, etc.[2]

Estructures
Fosfans lineals

Aquests hidrurs estan formats per cadenes d'àtoms de fòsfor enllaçats un rere l'altre i, cadascun també a un àtom d'hidrogen, excepte els terminats que ho estan a dos. La seva fórmula general és i s'han identificat fosfans que contenen fins a nou àtoms de fòsfor (). A partir de quatre àtoms de fòsfor existeixen isòmers amb cadenes laterals (isomeria de cadena) i estereoisòmers.[3]
En tots aquests composts el fòsfor presenta hibridació sp3 amb un dels quatre orbitals híbrids ocupat per una parella d'electrons que no formen enllaç. Aquest orbital ocupat no-enllaçant provoca una disminució dels angles entre els altres, que de 109,5° passen a només 93,5°. Aquestes característiques es repeteixen pels àtoms de fòsfor a les cadenes dels fosfans lineals.[3]
Els isòmers estructurals sorgeixen amb les cadenes ramificades. Per exemple l'hexafosfà té quatre isòmers estructurals de cadena, que són: , , i . Per altra banda, els àtoms de fòsfor interns poden ser asimètrics, mentre que els dels extrems no ho són mai perquè estan enllaçats a dos àtoms d'hidrogen. Això dona lloc a un nombre d'estereoisòmers que augmenta amb el nombre de fòsfors. Així l'hexafosfà no ramificat presenta quatre centres d'asimetria, ja que té quatre àtoms de fòsfor interns , i dona sis diastereòmers: quatre parelles d'enantiòmers i dues formes meso, que sumen deu estereoisòmers.[3]
-
 Ciclotrifosfà .
Ciclotrifosfà . -
 Ciclotetrafosfà .
Ciclotetrafosfà . -
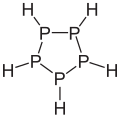 Ciclopentafosfà .
Ciclopentafosfà . -
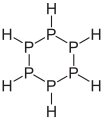 Ciclohexafosfà .
Ciclohexafosfà .
Fosfans cíclics
Els fosfans cíclics estan constituïts per anells amb àtoms de fòsfor enllaçats entre si i tenen fórmula general . S'han detectat compostos amb en mescles de fosfans, però només s'ha pogut aïllar el ciclopentafosfà . La molècula del ciclopentafosfà està formada per un anell de cinc àtoms de fòsfor enllaçats mitjançant enllaços covalents simples. Cada àtom de fòsfor està enllaçat a dos altres àtoms de fòsfor i a un àtom d'hidrogen.[3]
-
 .
. -
 .
. -
 .
.
Fosfans policíclics
Els fosfans policíclics tenen estructures en forma de gàbia on hom hi troba àtoms de fòsfor enllaçats a tres altres àtoms de fòsfor i alguns units només a dos, el tercer enllaç el forma amb àtoms d'hidrogen. La fórmula general és amb i L'anell predominant és el de cinc àtoms de fòsfor , ja que els angles d'un pentàgon són de 108°, essent els més propers als dels orbitals híbrids sp3 (109,5°) i presenten la mínima tensió. Els angles d'un quadrat són 90° i els d'un hexàgon 120°. Així el és una gàbia de 3 anells de 5 àtoms de fòsfor i un anell de només tres; el té quatre anells de 5 àtoms de fòsfor; i el té dos anells de cinc i dos anells de sis àtoms de fòsfor.[4]
Preparació
El disfosfà s'obté juntament amb el fosfà per hidròlisi del fosfur de calci impur que conté petites quantitats de difosfur de dicalci . La reacció és:[5]Si s'escalfa, el difosfà sofreix una reacció de desproporcionació i dona trifosfà i fosfà:[6]
El trifosfà és difícil d'aïllar perquè segueix reaccionant per desproporcionació i per reacció amb difosfà donant el tetrafosfà :[6]
El tetrafosfà reacciona amb el trifosfà a –20 °C i dona el ciclopentafosfà :[6]
Referències
- ↑ Gengembre, P. «Mémoire sur un nouveau gas obtenu, par l'action des substances alkalines, sur le phosphore de Kunckel». 'Mémoires de mathématique et de physique, 10, 1783, pàg. 651-658.
- ↑ 2,0 2,1 IUPAC. Nomenclatura de química inorgànica: recomanacions de 1990. Traducció: Enric Casassas i Simó, Joaquim Sales i Cabré. Barcelona: Institut d'Estudis Catalans. Secció de Ciències i Tecnologia, 1997. ISBN 84-7283-360-7.
- ↑ 3,0 3,1 3,2 3,3 Wiberg, Egon. Inorganic chemistry. 1st English ed.. San Diego: Academic Press, 2001. ISBN 0-12-352651-5.
- ↑ Steudel, Ralf. Chemistry of the Non-Metals : Syntheses - Structures - Bonding - Applications, 2020. ISBN 978-3-11-057806-5.
- ↑ Chandra, Sulekh. Comprehensive inorganic chemistry (for B. Sc 1st year). 1st ed., repr. New Delhi, India: New Age International (P) Ltd. Pub, 2004. ISBN 81-224-1512-1.
- ↑ 6,0 6,1 6,2 Greenwood, N. N.. Chemistry of the elements. 2a edició, 1997. ISBN 0-585-37339-6.








































