Živa(I) nitrat
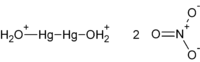 | |
| Nazivi | |
|---|---|
| IUPAC naziv Živa(I) nitrat | |
| Drugi nazivi Živin nitrat | |
| Identifikacija | |
| |
| ECHA InfoCard | 100.202.814 |
| Svojstva | |
| Hg2(NO3)2 (anhydrous) Hg2(NO3)2·2H2O (dihydrate) | |
| Molarna masa | 525,19 g/mol (anhidrat) 561,22 g/mol (dihidrat) |
| Agregatno stanje | Beli kristali (anhidrat) bezvojni kristali (dihidrat) |
| Gustina | ? g/cm3 (anhidrat) 4,8 g/cm3 (dihidrat) |
| Tačka topljenja | ? (anhidrat) razlaže se na 70°C (dihidrat) |
Rastvorljivost u vodi | neznatno rastvoran, reaktivan |
| Opasnosti | |
| NFPA 704 |  1 3 1 OX |
| Srodna jedinjenja | |
Drugi anjoni | Živa(I) fluorid Živa(I) hlorid Živa(I) bromid Živa(I) jodid |
Drugi katjoni | Živa(II) nitrat |
Ukoliko nije drugačije napomenuto, podaci se odnose na standardno stanje materijala (na 25 °C [77 °F], 100 kPa). | |
 Y verifikuj (šta je Y verifikuj (šta je  Y Y Н ?) Н ?) | |
| Reference infokutije | |
Živa(I) nitrat je hemijsko jedinjenje sa formulom Hg2(NO3)2. Ono se koristi u pripremi drugih živa(I) jedinjenja, i poput drugih živinih jedinjenje je toksično.
Reakcije
Živa(I) nitrat se formira kombinovanjem žive sa razblaženom azotnom kiselinom (koncentrovana azotna kiselina bi proizvela živa(II) nitrat). Živa(I) nitrat je redukujući agens koji se oksiduje u kontaktu sa vazduhom.
Rastvori živa(I) nitrata su kiseli usled spore reakcije sa vodom:
- Hg2(NO3)2 + H2O → Hg2(NO3)(OH) + HNO3
Hg2(NO3)(OH) formira žuti talog.
Ako se rastvor zagreje do ključanja ili izloži svetlosti, živa(I) nitrat podleže reakciji disproporcionacije proizvodeći elementarnu živu i živa(II) nitrat[2]:
- 2Hg2(NO3)2 → Hg + Hg(NO3)2









