Aluminiumtriacetaat
| Aluminiumtriacetaat | ||||
|---|---|---|---|---|
| Algemeen | ||||
| Molecuulformule | ||||
| IUPAC-naam | Aluminiumacetaat | |||
| Andere namen | Aluminium(III)acetaat | |||
| Molmassa | 204,113[1] g/mol | |||
| SMILES | CC(=O)[O-].CC(=O)[O-].CC(=O)[O-].[Al+3] | |||
| CAS-nummer | 139-12-8 | |||
| PubChem | 8757 | |||
| Wikidata | Q27861942 | |||
| Waarschuwingen en veiligheidsmaatregelen | ||||
| Fysische eigenschappen | ||||
| Smeltpunt | (ontleedt) 120 °C | |||
| Tenzij anders vermeld zijn standaardomstandigheden gebruikt (298,15 K of 25 °C, 1 bar). | ||||
| ||||
Aluminiumtriacetaat, volgens de officiële naamgevingsregels: aluminiumacetaat,[2] is een chemische verbinding met de molecuulformule . Onder standaardomstandigheden is het een witte, wateroplosbare, vaste stof[3] die ontleed bij ongeveer 200 °C.[4] Bij oplossen in water hydrolyseert het triacetaat tot een mengsel van basische, hydroxide/acetaten (aluminiummonoacetaat en aluminiumdiacetaat),[5]. Deze verbindingen vormen een chemisch evenwicht met elkaar. De naam aluminiumacetaat wordt ook vaak voor dit mengsel gebruikt.

Raadpleeg bij gezondheidsklachten een arts.
Aluminiumtriacetaat heeft een aantal medicinale toepassingen vanwege zijn jeukverlichtende, astringente en antiseptische eigenschappen.[6] Als receptvrij medicament wordt het als burowwater[7] toegepast in de behandeling van infecties van de uitwendige gehoorgang.[8][9] In combinatie met aminozuren wordt burowwater gebruikt om te gorgelen in de bestrijding van aften's.[10] In de diergeneeskunde wordt aluminiumtriacetaat toegepast in de bestrijding van de ziekte van Mortellaro in runderen.[11]
Net als de andere aluminiumacetaten wordt het triacetaat toegepast om verfstoffen aan textiel te laten hechten.[12] Samen met aluminiumdiacetaat[13] of aluminiumsulfacetaat[14] wordt het gebruikt voor katoen en andere cellulosevezels[15] en zijde.[14] Het is ook gecombineerd met ijzer(II)acetaat, waarbij verschillende kleuren ontstaan.[16]
Naamgeving
Volgens de regels voor de naamgeving van anorganische verbindingen van de IUPAC is de naam voor : aluminiumacetaat,[2] hoewel meer formele namen als aluminium(III)acetaat of aluminiumethanoaat ook acceptabel zijn.[5] Het gebruik van het telwoord "tri" is officieel niet noodzakelijk, maar wordt vaak wel gebruikt om mogelijke verwarring te voorkomen met een aantal verwante verbindingen waarin hydroxide ook als ligand optreedt: basisch aluminium diacetaat, , en basuisch aluminium monoacetaat, . Als vaste stoffen zij het drie duidelijk verschillende verbindingen, die als groep samen als aluminiumacetaat behandeld worden. In oplossing zijn de verbindingen in snel chemisch evenwicht met elkaar, dit ten gevolge van het hydrolyzeren van de hogere acetaten.[5] Afkortingen als AlAc[17], samen met varianten daarop zoals en worden in de geochemie soms gebruikt ,[18] hoewel ze niet consistent zijn met de standaard praktijk in de chemie.
Structuur
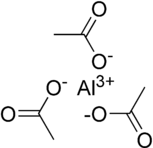 |  |
| Weergave van de structuur van als ionogeen zout (links) en als covalent gebonden stof (rechts) | |
De formule verwijst naar de aanwezigheid van aluminium-ionen met oxidatiegetal (3+) en acetaatgroepen in de verhouding 1 : 3. Afbeeldingen om de verbinding weer te geven, zoals de twee hier rechts zijn twee zeer ver vereenvoudigde pogingen tot weergave van de structuur van de vaste stof. De linker is een puur ionogeen zout waarin een enkel aluminium(III)-kation omgeven wordt, en elektrostatisch gekoppeld is aan drie acetaat-anionen, . Dit kan echter niet gelezen worden als de weergave van de kristalstructuur van de verbinding:
- Zo heeft bijvoorbeeld natriumchloride, , een stoichiometrie van 1 : 1, maar heeft het een kubische kristalstructuur, waarin ieder ion een octaëdrische omringen heeft van zes ionen met de tegengestelde lading.[19] De krachten die het kristal bijeenhouden zijn elektrostatisch van aard.
- De meest rechtse van de twee afbeeldingen geeft de drie acetaatgroepen weer alsof zij covalent gebonden zijn aan het metaal-ion en daarmee, in ieder geval voor de zuurstofatomen die direct aan het metaal gekoppeld zijn, een trigonale vlakke structuur vormen. Intermoleculaire krachten zijn verantwoordelijk voor het bijeenhouden van het kristal.
Het is waarschijnlijk dat in de vaste toestand er geen sprake is van een óf .. óf situatie: De structuur zal zowel ionische als covalente kenmerken vertonen en er is waarschijnlijk sprake van meerdere aluminiumionen en/of bruggende acetaat-liganden. Beide structuurelementen zijn aangetoond in oplossingen van aluminiumacetaat,[20] en van aluminiumchloride is bekend dat het als dimeer voorkomt: .[21]

NMR-gegevens van waterige aluminiemacetaat-oplossingen geven aan dat aluminium voorkomt als een hexaaquacomplex, ,[22] naast een aantal andere mononucleaire[23] complexen met een andere substitutiepatroon. Daarnaast bestaat in oplossing een groot deel uit -complexen,[24] een deeltje dat in een aantal (tegenstrijdige) mechanismen van hydrolyse en polymerisatie een rol speelt.[25]
Ook van andere driewaardige kationen is bekend dat ze makkelijk polynucleaire deeltjes vormen: een voorbeeld daarvan is ijzer(III)acetaat (zie hiernaast) dat een trinucleaire[26] structuur heeft[27] met een drievoudig bruggend zuurstofatoom in het midden.[28] waarin het kation voorkomt.[29] De stof chroom(III)acetaathydroxide, is als isostructureel beschreven.[30] Analoge verbindingen zijn beschreven voor ruthenium(III), vanadium(III), rodium(III) en iridium(III).[31] Van koper(II)acetaat en chroom(II)acetaat zijn dinucleaire structuren, bekend,[32] evenals van rodium(II)acetaat;[33] in elk van deze stoffen is een sterke metaal-metaal-interactie aanwezig.[32][33]
Chemie
Synthese
Aluminiumtriacetaat is een witte, wateroplosbare vaste stof die gewoonlijk gesynthetiseerd wordt op basis van aluminiumchloride of direct uit aluminium door dit te verhitten in azijnzuur en azijnzuuranhydride.[3]
Theoretisch kunnen alle aluminiumacetaten bereid worden uit aluminiumhydroxide of natriumaluminaat en azijnzuur, maar de vorming van het triacetaat treedt alleen op in afwezigheid van water.[5] In oplossingen is het diacetaat het voornaamste product, dat ook ontstaat als aluminiumchloride en natriumacetaat in een basische waterige oplossing met elkaar reageren.[34] De reactievergelijkingen voor deze processen zijn:
Voor een verbeterd proces op basis van aluminiumchloride en natriumaluminaat waarbij het natriumacetaat in situ bereid wordt is patent aangevraagd:[35]
Als hechtingsmiddelen voor kleurstoffen aan textiel wordt aluminiumtriacetaat en aluminiumsulfacetaat, dat bereid op basis van aluminiumsulfaat. Het uiteindelijke product wordt bepaald door de gebruikte hoeveelheid lood(II)acetaat:[14]
Ontleding
Boven 200 °C ontleedt aluminiumtriacetaat op een manier die vergeleken kan worden met die van aluminiumformiaat.[4] De ontleding begint met het verlies van azijnzuuranhydride () tussen 120 en 140 °C[3] waarbij een mengsel ontstaat van basische oxides en acetaten zoals bijvoorvoorbeeld en ,[34] die uiteindelijk worden omgezet in (alumina), eerst als een amorfe, watervrije vaste stof die via een aantal verschillende vaste kristallijne fases (γ, δ, en θ) overgaat in polymorf α-:[4]
Hydrolyse
Aluminiumtriacetaat hydrolyseert waarbij zowel het mono- als het dibasische hydroxideacetaat ontstaan. Dit vindt zowel plaats in oplossingen als door het hygroscopisch vocht opnemen uit de lucht:[5]
Toepassingen

Raadpleeg bij gezondheidsklachten een arts.
De alumininiumacetaten worden bij mensen toegepast als lokaal antisepticum, waarbij het bovendien werkt als astringent.[6] De werking als astringent wordt ook toegepast bij de behandeling van de ziekte van Mortellaro in runderen.[11] Aluminiumacetaten bevorderen de genezing van geïnfecteerde huid en hebben een positief effect bij de behandeling van jeuk, ontstekingen en insectensteken.[6] De Amerikaanse Food and Drug Administration heeft de toepassing goedgekeurd als "tijdelijk verlichting biedend medicijn voor kleinere huidaandoeningen ten gevolge van ... gifsumak, insectenbeten, zwemmerseczeem of 'irritaties ontstaan door contact met zeep, detergentia, cosmetica of sieraden'"[36] Voor deze receptvrije toepssingen wordt vaak Burowwater gebruikt,[7] verdunde vormen daarvan worden gebruikt om te gorgelenter bestrijding van aften.[10] De grootste toepassing van Burowwater is de behandeling van ontstekingen van de uitwendige gehoorgang[8][9] inclusief otomycosis, hoewel het voor schimmelinfecties minder effectief is dan clotrimazol in de behandeling van schimmelinfecties.[37] Plaatseijkwerkend astringent poeder Domeboro bevat aluminiumsulfaattetradecahydraat, , en calciumacetaatmonohydraat, . Als het poeder vochtig wordt of wordt opgelost vormt het Burowwater.[38] Oplossingen van het poeder in warm water kunnen gebruikt worden bij de behandeling van ingegroeide nagels,[39] zowel irritatie als eventuele infecties worden bestreden.
Hechting voor textielverf, mordant

Om textielverf goed aan de stof te koppelen zodat een wasechte kleur ontstaat, wordt gebruik gemaakt van speciale hechtingsmiddelen, ook mordant genaamd. Een mordant vormt meestal een geladen complex met de kleurstof, die vervolgens aan de stof hecht.[41] Een mordant bevat doorgaans een meerwaardig metaal-ion, vaak aluminium of ijzer,[42] zoals bij de mengsels met aluminiumacetaat of aluminiumsufacetaat.[13][14] Mordanten op basis van aluminiumtriacetaat worden gebruikt in combinatie met katoen en andere op cellulose gebaseerde vezels,[15] en zijde.[14] Combinatie met ijzer(II)acetaat is ook mogelijk,maar daarbij ontstaan andere kleuren.[16]

In het geval van de kleurstof alizarine (1,2-dihydroxyantrachinon, [43], werd in 1965 door Kiel en Heertjes aangenomen dat het dianion van alizarine een vijfvoudig coördinatiecomplex met aluminium(III) vormt, ,[44] dat door opname van water overgaat in een zesvoudig gecoördineerd di-anion, .[45] De structuurtoekenning was gebaseerd op infraroodspectroscopie. In 1994 kwam van Wunderlich en Bergerhoff een tweede voorstel voor de structuur. In dit structuurvoorstel werd gebruik gemaakt van 27Al-NMR en electrospray ionisatie. Zij gaven een structuur aan met twee aluminium-atomen , beide door twee alizarine-moleculen gecomplexeerd die via bruggende waterligeanden aan elkaar gekoppeld waren, .[40][46] Het marte van hydratatie was afhankelijk van het tegen-ion: met natrium werd een stabieltetrahydraat gevormd, kalium gaf aanleiding tot het monohydraat. De verschillende hydraten gaven aanleiding tot een verschill in chemisch verschuiving in het 27Al-NMR, wat aangeeft dat de watermoleculen of gekoppeld zijn aan de aluminium-ionen, of aan de alizarine-moleculen. Zij hebben een effect dat niet in overeenstemming is met "gewone" hydraterende watermaleculen.[46]
Een aan de laatste structuur verwant voorstel kwam in 1996 van Soubayrol et al, waarin de alizarine-moleculen niet alleen door aluminium, maar ook daar complexatie aan calcium met elkaar gekoppeld waren. De bruggen tussen de aluminium-ionen kunnen dan geschreven worden als terwijl ook de bruggen door de watermoleculen overgenomen worden uit het voorstel van Wunderlich en Bergerhoff. De aluminium-ionen zijn gekoppeld aan de gedeprotoneerde fenol-resten van de kleurstof:[12] in het model van Soubayrol is elk alizarinemolecuul gekoppeld aan één aluminium-ion.[46] Over de structuur van de aan textiel gehechte kleurstof wordt in geen van de modellen een uitspraak gedaan.
- Dit artikel of een eerdere versie ervan is een (gedeeltelijke) vertaling van het artikel Aluminium triacetate op de Engelstalige Wikipedia, dat onder de licentie Creative Commons Naamsvermelding/Gelijk delen valt. Zie de bewerkingsgeschiedenis aldaar.
- ↑ Berekend op basis van de op 2 jan 2022 in de Nederlandse Wikipedia voor de verschillende elementen vermelde atomaire massa's
- ↑ a b International Union of Pure and Applied Chemistry (2005). Nomenclature of Inorganic Chemistry IUPAC Recommendations 2005. RSC Publishing. ISBN 0854044388.
- ↑ a b c Handbook of Inorganic Compounds. CRC Press (1995), p. 3. ISBN 9780849386718.
- ↑ a b c Sato, Taichi, Ikoma, Shuji, Ozawa, Fusaji (1984). Thermal decomposition of organic basic aluminium salts—formate and acetate. Thermochim. Acta 75 (1–2): 129–137. DOI: 10.1016/0040-6031(84)85013-3.
- ↑ a b c d e A Dictionary of Chemistry, 6th. Oxford University Press (2008), "Aluminium ethanoate (aluminium acetate)". ISBN 9780191726569.
- ↑ a b c Aluminum Acetate (Code C47387). National Cancer Institute thesaurus (NCIt) (October 31, 2016). Gearchiveerd op 16 december 2016. Geraadpleegd op 15 november 2016.
- ↑ a b Acetic acid / aluminum acetate solution. Drugs.com (3 november 2016). Geraadpleegd op 23 november 2016.
- ↑ a b Thorp, M. A., Kruger, J., Oliver, S., Nilssen, E. L. K., Prescott, C. A. J. (1998). The antibacterial activity of acetic acid and Burow's solution as topical otological preparations. J. Laryng. Otol. 112 (10): 925–928. PMID 10211213. DOI: 10.1017/S0022215100142100.
- ↑ a b Kashiwamura, Masaaki, Chida, Eiji, Matsumura, Michiya, Nakamaru, Yuuji, Suda, Noriyuki (2004). The Efficacy of Burow's Solution as an Ear Preparation for the Treatment of Chronic Ear Infections. Otol. Neurotol. 25 (1): 9–13. PMID 14724484. DOI: 10.1097/00129492-200401000-00002.
- ↑ a b US granted 5250569, : Amino acid flavorings of aluminum astringent for oral use, published: 1993-10-05, filing date: 1991-04-22internet
- ↑ a b US granted 8703104, Morelli, Joseph P. ; Fernandes, Jeffrey R. ; Verkaar, Edward L. C. ; Vogt, Petra: Use of metal astringents for the treatment of hairy heel warts, published: 2014-04-22, filing date: 2007-10-25, assigned to: Ecolabinternet
- ↑ a b c (de) Wunderlich, Christian-Heinrich, Bergerhoff, Günter (1994). Konstitution und Farbe von Alizarin- und Purpurin-Farblacken. Chem. Ber. 127 (7): 1185–1190. DOI: 10.1002/cber.19941270703.
- ↑ a b Haar, Sherry, Schrader, Erica, Gatewood, Barbara M. (2013). Comparison of aluminum mordants on the colorfastness of natural dyes on cotton. Cloth. & Textiles Res. J. 31 (2): 97–108. DOI: 10.1177/0887302X13480846.
- ↑ a b c d e Georgievics, Von (2013). The Chemical Technology of Textile Fibres – Their Origin, Structure, Preparation, Washing, Bleaching, Dyeing, Printing and Dressing. Read Books. ISBN 9781447486121.
- ↑ a b Brown, Donna, de Souza, Diane, Ellis, Catharine (2010). How to Mordant Cotton—let me count the ways. Turkey Red Journal 15 (2). Gearchiveerd van origineel op 27 februari 2021. Geraadpleegd op 15 januari 2022.
- ↑ a b Ellis, Catharine (2016). The Weaver's Studio Woven Shibori. F+W Media, Inc., "Transformative Processes", 83–84. ISBN 9781632503541.
- ↑ AlAc: De afkorting Ac heeft hier geen betrekking op het chemische element actinium, maar staat voor de acetaatgroep:
- ↑ Wesolowski, D. J., Blencoe, J. G., Cole, D. R., Bell, J. L. S., Palmer, D. A. (1992). Summaries of FY 92 Geosciences Research. United States Department of Energy, "Geochemistry of Crustal Processes to High Temperatures and Pressures", 38–44.
- ↑ Myerson, Allan S., Ginde, Rajiv (2002). Handbook of Industrial Crystallization, 2nd. Butterworth-Heinemann, "Crystals, Crystal Growth, and Nucleation", p. 37. ISBN 9780080533513.
- ↑ Alcock, Nathaniel W., Tracy, Valerie M., Waddington, Thomas C. (1976). Acetates and acetato-complexes. Part 2. Spectroscopic studies. J. Chem. Soc., Dalton Trans. 1976 (21): 2243–2246. DOI: 10.1039/DT9760002243.
- ↑ A Dictionary of Chemistry, 6th. Oxford University Press (2008), "ALuminium chloride". ISBN 9780191726569.
- ↑ Kubicki, J. D., Sykes, D., Apitz, S. E. (1999). Ab Initio Calculation of Aqueous Aluminum and Aluminum−Carboxylate Complex Energetics and 27Al NMR Chemical Shifts. J. Phys. Chem. A 103 (7): 903–915. DOI: 10.1021/jp983462w.
- ↑ Mononucleair: slechts één aluminiumatoom bevattend complex.
- ↑ Thomas, Fabien, Masion, Armand, Bottero, Jean Yves, Rouiller, James, Genevrier, Francine (1991). Aluminum(III) Speciation with Acetate and Oxalate. A Potentiometric and 27Al NMR Study. Environ. Sci. Technol. 25 (9): 1553–1559. DOI: 10.1021/es00021a004.
- ↑ Bi, Shuping, Wang, Chenyi, Cao, Qing, Zhang, Caihua (2004). Studies on the mechanism of hydrolysis and polymerization of aluminum salts in aqueous solution: correlations between the "Core-links" model and "Cage-like" Keggin-Al13 model. Coord. Chem. Rev. 248 (5–6): 441–455. DOI: 10.1016/j.ccr.2003.11.001.
- ↑ Trinucleair: een drie ijzeratomen/-ionen bevattend complex.
- ↑ (de) Weinland, R., Dinkelacker, P. (1909). Über Salze einer Hexaacetato(formiato)-trichrombase. II. Ber. Dtsch. Chem. Ges. 42 (3): 2997–3018. DOI: 10.1002/cber.19090420318.
- ↑ Figgis, B. N., Robertson, G. B. (1965). Crystal-Molecular Structure and Magnetic Properties of Cr3(CH3.COO)6OCl.5H2O. Nature 205 (4972): 694–695. DOI: 10.1038/205694a0.
- ↑ Burgess, J., Twigg, M. V. (2005). Encyclopedia of Inorganic Chemistry, 10th. Wiley. ISBN 9780470860786.
- ↑ Chromium(III) Acetate Hydroxide. chemicalbook.com. The chemical book (2016). Geraadpleegd op 18 november 2016.
- ↑ Catterick, Janet, Thornton, Peter (1977). Advances in Inorganic Chemistry and Radiochemistry. Academic Press, "Structures and Physical Properties of Polynuclear Carboxylates", 291–362. ISBN 9780080578699.
- ↑ a b Van Niekerk, J. N., Schoening, F. R. L. (1953). X-Ray Evidence for Metal-to-Metal Bonds in Cupric and Chromous Acetate. Nature 171 (4340): 36–37. DOI: 10.1038/171036a0.
- ↑ a b Cotton, F. A., Deboer, B. G., Laprade, M. D., Pipal, J. R., Ucko, D. A. (1971). The crystal and molecular structures of dichromium tetraacetate dihydrate and dirhodium tetraacetate dihydrate. Acta Crystallogr. B 27 (8): 1664. DOI: 10.1107/S0567740871004527.
- ↑ a b Wade, K., Banister, A. J. (1973). Comprehensive Inorganic Chemistry. Elsevier, "The Chemistry of Aluminium, Gallium, Indium and Thallium", p. 1047. ISBN 9781483153223.
- ↑ US granted 6498262, Jerome, James E. ; Fleming, Glenda L. ; Swinson, Joel H.: Process for producing aluminum diacetate monobasic, published: 2002-12-24, filing date: 2001-01-17, assigned to: Chattem Chemicals, Inc.internet
- ↑ Food and Drug Administration (1 april 2016). CFR – Code of Federal Regulations Title 21. United States Department of Health and Human Services, "Part 347 – Skin Protectant Drug Products for Over-The-Counter Human Use". Geraadpleegd op 15 november 2016.
- ↑ Munguia, Raymundo, Daniel, Sam J. (2008). Ototopical antifungals and otomycosis: A review. Int. J. Ped. Otorhinolaryng. 72 (4): 453–459. PMID 18279975. DOI: 10.1016/j.ijporl.2007.12.005.
- ↑ Domeboro – aluminum sulfate tetradecahydrate, calcium acetate monohydrate powder, for solution. DailyMed. U.S. National Library of Medicine (12 May 2016). Geraadpleegd op 23 november 2016.
- ↑ Simon, Harvey, "Ingrown Toenails", 31 January 2013. Geraadpleegd op 23 november 2016.
- ↑ a b Atta-ur-Rahman (2002). Bioactive Natural Products (Part G). Elsevier, "Rubia tinctorum L", 629–684. ISBN 9780080542065.
- ↑ IUPAC, Compendium of Chemical Terminology, 2nd ed. (the "Gold Book") (1997). Online corrected version: (2006–)
mordant - ↑ Llewellyn, Bryan D., "Stain Theory – How mordants work", May 2005. Gearchiveerd op 14 augustus 2007.
- ↑ : De twee genoteerde waterstofatomen zijn de waterstofatomen in de hydroxygroepen, Az staat voor de rest van het alizarine-molecuul.
- ↑ Kiel, E. G., Heertjes, P. M. (1965). Metal Complexes of Alizarin V—Investigations of Alizarin–dyed Cotton Fabrics. Coloration Technology 81 (3): 98–102. DOI: 10.1111/j.1478-4408.1965.tb02647.x.
- ↑ Kiel, E. G., Heertjes, P. M. (1963). Metal Complexes of Alizarin I—The Structure of the Calcium–Aluminium Lake of Alizarin. Coloration Technology 79: 21–27. DOI: 10.1111/j.1478-4408.1963.tb02507.x.
- ↑ a b c Soubayrol, Patrick, Dana, Gilbert, Man, Pascal P. (1996). Aluminium-27 Solid-State NMR Study of Aluminium Coordination Complexes of Alizarin. Magnetic Resonance in Chemistry 34 (8): 638–645. DOI: <638::AID-OMR926>3.0.CO;2-5 10.1002/(SICI)1097-458X(199608)34:8<638::AID-OMR926>3.0.CO;2-5.











![{\displaystyle {\ce {[Fe3(\mu_3- O)(CH3COO)6.(H2O)3]+}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/d84b7c886676936187016297417f4f90d5b10e88)























![{\displaystyle {\ce {Ca[Al(H2O)(OH)Az2].2H2O}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/02e537988c8d0fd03dca93a2b145629212faa04b)



![{\displaystyle {\ce {Ca[Al(H2O)(OH)Az2].H2O}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/bc5b1178ee2a8cf8aa11f9e57ac13f0a95c48adf)











