臭化鉄(II)
| 臭化鉄(II) | |
|---|---|
 | |
Iron(II) bromide | |
別称 Ferrous bromide | |
| 識別情報 | |
| CAS登録番号 | 7789-46-0  |
| PubChem | 425646 |
| ChemSpider | 74218  |
| UNII | EA3X054RBZ  |
| |
| |
| 特性 | |
| 化学式 | FeBr2 |
| モル質量 | 215.65 g mol-1 |
| 外観 | 黄色-茶色固体 |
| 密度 | 4.63 g cm-3, 固体 |
| 融点 | 684 °C, 957 K, 1263 °F ((無水物) |
| 沸点 | 934 °C, 1207 K, 1713 °F |
| 水への溶解度 | 117 g / 100 ml |
| 他の溶媒への溶解度 | テトラヒドロフラン、メタノール、エタノール |
| 磁化率 | +13,600・10-6 cm3/mol |
| 構造 | |
| 結晶構造 | 菱面体晶, hP3, 空間群 = P-3m1, No. 164 |
| 配位構造 | 八面体 |
| 危険性 | |
| 主な危険性 | none |
| Rフレーズ | R20 R36/37/38 |
| Sフレーズ | S26 S36 |
| 関連する物質 | |
| その他の陰イオン | 塩化鉄(II) |
| その他の陽イオン | 臭化鉄(III) |
| 関連するcompounds | VBr2 |
| 特記なき場合、データは常温 (25 °C)・常圧 (100 kPa) におけるものである。 | |
臭化鉄(II)(Iron(II) bromide)は、化学式FeBr2の無機化合物である。無水物は黄色または茶色の常磁性固体である。何種類かの水和物も知られており、全てが淡い色の固体である。研究室において、他の鉄化合物の一般的な前駆体として用いられるが、この化合物自体の用途はない。
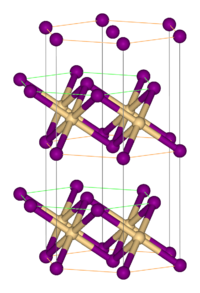
構造
多くの金属ハロゲン化物と同様に、臭化鉄(II)は、ハロゲン化物で架橋された孤立した金属中心からなるポリマー構造である。臭化物イオンの密な層の間の八面体状の穴にFe(II)が位置するヨウ化カドミウム型に結晶化する[1]。ハロゲン化物イオンの重なり方は、塩化カドミウム型の塩化鉄(II)とは、若干異なる。
合成と構造
臭化鉄(II)は、濃臭化水素酸と鉄粉末のメタノール溶液を用いて合成される。メタノール溶媒和物[Fe(MeOH)6] Br2と水素ガスを一緒に添加し、メタノール複合体を真空中で加熱する事で、純粋な臭化鉄(II)が得られる[2]。
臭化鉄(II)は、2等量の臭化テトラエチルアンモニウムと反応し、[(C2H5)4N]2FeBr4を与える[3]。また、臭化物や臭素と反応し、濃い色で混合原子価である[FeBr3Br9]-を形成する[4]。
磁性
臭化鉄(II)は、4.2 Kで強いメタ磁性を持ち、典型的なメタ磁性化合物として、長い間研究されてきた[5][6]。
出典
- ^ Haberecht, J.; Borrmann, Η.; Kniep, R. (2001). “Refinement of the crystal structure of iron dibromide, FeBr2”. Zeitschrift fur Kristallographie - New Crystal Structures 216 (1-4). doi:10.1524/ncrs.2001.216.14.544.
- ^ Winter, G. (1973). “Iron(II) Halides”. Inorganic Syntheses. Inorganic Syntheses. 14. pp. 99-104. doi:10.1002/9780470132456.ch20. ISBN 9780470132456
- ^ N. S. Gill, F.. B. Taylor Inorganic Syntheses 1967, volume 9, page 136-142. doi: 10.1002/9780470132401.ch37
- ^ Holleman, A. F.; Wiberg, E. "Inorganic Chemistry" Academic Press: San Diego, 2001. ISBN 0-12-352651-5
- ^ Wilkinson, M. K.; Cable, J. W.; Wollan, E. O.; Koehler, W. C. (15 January 1959). “Neutron Diffraction Investigations of the Magnetic Ordering in FeBr2, CoBr2, FeCl2, and CoCl2”. Physical Review 113 (2): 497-507. Bibcode: 1959PhRv..113..497W. doi:10.1103/PhysRev.113.497.
- ^ Jacobs, I. S.; Lawrence, P. E. (10 December 1967). “Metamagnetic Phase Transitions and Hysteresis in FeCl2”. Physical Review 164 (2): 866-878. Bibcode: 1967PhRv..164..866J. doi:10.1103/PhysRev.164.866.
| |
|---|---|
| 二元化合物 |
|
| 三元化合物 |
|
| 四元・五元化合物 |
|
| |








