Réduction des composés nitro
Les réductions des composés nitro sont un ensemble de réactions chimiques visant à convertir les groupes nitro (—NO2) présents dans certains composé organiques principalement en groupes amine (—NH2), mais aussi d'autres, comme les groupes hydroxylamine (—NHOH), hydrazines (R-N-N-R) ou azos (R-N=N-R), voire une réduction complète en groupe alkyle, via des réactions de réduction utilisant divers agents. Les composés réagissent différemment selon qu'ils soient alkyliques ou aryliques.
C'est une réaction particulièrement intéressante pour les composé aromatiques car elle permet l'introduction d'un groupe amine qui serait sinon bien plus difficile à introduire ou avec moins de contrôle sur sa position. Elle suit en général l'introduction du groupe nitro, par exemple par nitration d'un groupe phénol.
Composés nitro aromatiques
Réduction en anilines
La réduction des composés nitro aromatiques est faite à l'échelle industrielle[1]. De nombreuses méthodes existent :
- hydrogénation catalytique utilisant : le nickel de Raney[2] ou le palladium sur charbon[3],[4],[5], l'oxyde de platine(IV), ou le nickel d'Urushibara[6] ;
- fer en milieu acide[7],[8],[9] ;
- hydrosulfite de sodium[10] ;
- sulfure de sodium (ou sulfure d'hydrogène et base), illustré par exemple par la réduction sélective du dinitrophénol en nitroaminophénol[11] ;
- chlorure d'étain(II)[12] ;
- chlorure de titane(III) ;
- samarium[13] ;
- acide iodhydrique[14].
Les hydrures métalliques ne sont en général pas utilisés pour réduire les composé nitro aryliques en anilines car ils tendent à produire des composés azo.
Réduction en hydroxylamines
Diverses méthodes ont été décrites pour produire des hydroxylamines aryliques à partir de leur équivalent nitro :
- nickel de Raney et hydrazine à 0-10 °C[15] ;
- réduction électrolytique[16] ;
- zinc métallique dans le chlorure d'ammonium aqueux[17] ;
- rhodium sur charbon catalytique avec du monohydrate d'hydrazine en excès, à température ambiante[18].
Réduction en hydrazines
Le traitement des nitroarènes avec du zinc métallique en excès provoque la formation de N,N'-diarylhydrazine[19].
Réduction en composés azo
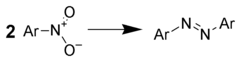
Le traitement des nitroarènes avec des hydrures métalliques donne des composés azo avec de bons rendements. On peut utiliser par exemple :
- le tétrahydruroaluminate de lithium (LiAlH4)[20] ;
- le zinc métallique avec de l'hydroxyde de sodium[19] ; si le zinc est mis en excès, le groupe azo sera réduit en hydrazine.
Composés nitro aliphatiques
Réduction en alcanes

L'hydrodénitration (remplacement d'un groupe nitro par un hydrogène) est difficile à réaliser mais peut être effectué par hydrogénation catalytique par le platine sur gel de silice à hautes températures[21].
La réaction peut également être effectuée par réaction radicalaire avec l'hydrure de tributylétain et un amorceur radicalaire, par exemple l'AIBN[22].
Réduction en amines

Les composés nitro aliphatiques peuvent être réduits en amines par divers réactifs/procédés :
- hydrogénation catalytique en utilisant l'oxyde de platine(IV) (PtO2)[23] ou nickel de Raney[24] ;
- fer métallique en reflux dans l'acide acétique[25] ;
- iodure de samarium(II)[26] ;
- nickel de Raney, platine sur charbon (en) (Pt/C), ou poudre de zinc et acide formique ou formiate d'ammonium[6].
Les composé nitro α,β-insaturés peuvent être réduits en amines saturés par :
- hydrogénation catalytique avec palladium sur charbon (Pd/C) ;
- le fer métallique
- le tétrahydruroaluminate de lithium[27] ; dans ce cas de figure, la réaction produit aussi des hydroxylamines et des oximes comme impuretés ;
- le borohydrure de lithium ou le borohydrure de sodium et le chlorure de triméthylsilyle[28] ;
- le Red-Al[29].
Réduction en hydroxylamines

Les composés nitro aliphatiques peuvent être réduits en hydroxylamines aliphatiques en utilisant du diborane[30].
La reaction peut également être effectuée avec de la poudre de zinc et du chlorure d'ammonium[31],[32],[33] :
- R-NO2 + 4 NH4Cl + 2 Zn → R-NH-OH + 2 ZnCl2 + 4 NH3 + H2O
Réduction en oximes

Les composés nitro sont typiquemen réduit en oximes en utilisant des sels métalliques, par exmple le chlorure d'étain(II)[34] ou le chlorure de chrome(II)[35].
Il est également possible de passer par une hydrogénation catalytique avec une quantité contrôlée de dihydrogène[36].
Notes et références
- (en) Cet article est partiellement ou en totalité issu de l’article de Wikipédia en anglais intitulé « Reduction of nitro compounds » (voir la liste des auteurs).
- ↑ Gerald Booth, « Nitro Compounds, Aromatic », dans Ullmann's Encyclopedia of Industrial Chemistry, (ISBN 978-3527306732, DOI 10.1002/14356007.a17_411)
- ↑ Allen, C. F. H.; VanAllan, J., 2-Amino-p-cymene, Org. Synth., coll. « vol. 3 », , p. 63
- ↑ Bavin, P. M. G., 2-Aminofluorene, Org. Synth., coll. « vol. 5 », , p. 30
- ↑ Michael B. Smith et Jerry March, March's Advanced Organic Chemistry, John Wiley & Sons, , 6th éd. (ISBN 978-0-471-72091-1), p. 1816
- ↑ Siya Ram et Richard E. Ehrenkaufer, « A general procedure for mild and rapid reduction of aliphatic and aromatic nitro compounds using ammonium formate as a catalytic hydrogen transfer agent », Tetrahedron Letters, vol. 25, no 32, , p. 3415–3418 (DOI 10.1016/S0040-4039(01)91034-2, hdl 2027.42/25034
 )
) - ↑ a et b (en) J. P. Adams, « Nitro and related groups », Journal of the Chemical Society, Perkin Transactions 1, no 23, , p. 2586–2597 (DOI 10.1039/b009711j)
- ↑ Fox, B. A.; Threlfall, T. L., 2,3-Diaminopyridine, Org. Synth. 44, coll. « vol. », , 34 p.
- ↑ S. A. Mahood et P. V. L. Schaffner\doi=10.15227/orgsyn.011.0032, « 2,4-Diaminotoluene », Organic Syntheses, vol. 11, , p. 32 (DOI 10.15227/orgsyn.011.0032)
- ↑ « O-Aminobenzaldehyde, Redox-Neutral Aminal Formation and Synthesis of Deoxyvasicinone », Organic Syntheses, vol. 89, , p. 274 (DOI 10.15227/orgsyn.089.0274
 )
) - ↑ Redemann, C. T.; Redemann, C. E., 5-Amino-2,3-dihydro-1,4-phthalazinedione, Org. Synth., coll. « vol. 3 », , p. 69
- ↑ 2-Amino-4-nitrophenol, Org. Synth. 25, coll. « vol. », , 5 p.
- ↑ Margaret M. Faul et Oliver R. Thiel, « Tin(II) Chloride », dans Encyclopedia of Reagents for Organic Synthesis, (ISBN 9780470842898, DOI 10.1002/047084289X.rt112.pub2)
- ↑ Basu, M. K., « Ultrasound-promoted highly efficient reduction of aromatic nitro compounds to the aromatic amines by samarium/ammonium chloride », Tetrahedron Lett., vol. 41, no 30, , p. 5603–5606 (DOI 10.1016/S0040-4039(00)00917-5)
- ↑ J. S. Dileep Kumar, ManKit M. Ho et Tatsushi Toyokuni, « Simple and chemoselective reduction of aromatic nitro compounds to aromatic amines: reduction with hydriodic acid revisited », Tetrahedron Letters, vol. 42, no 33, , p. 5601–5603 (DOI 10.1016/s0040-4039(01)01083-8)
- ↑ Ayyangar, N. R., Brahme, K. C., Kalkote, U. R. et Srinivasan, K. V., « Facile Transfer-Reduction of Nitroarenes to N Arylhydroxylamines with Hydrazine in the Presence of Raney Nickel », Synthesis, vol. 1984, no 11, , p. 938 (DOI 10.1055/s-1984-31027)
- ↑ Harman, R. E., Chloro-p-benzoquinone, Org. Synth., coll. « vol. 4 », , p. 148
- ↑ Kamm, O., β-Phenylhydroxylamine, Org. Synth., coll. « vol. 1 », , p. 445
- ↑ Ichikawa, S., Zhu, S. et Buchwald, S., « A Modified System for the Synthesis of Enantioenriched N-Arylamines through Copper-Catalyzed Hydroamination », Angewandte Chemie International Edition, vol. 57, no 28, , p. 8714–8718 (PMID 29847002, PMCID 6033674, DOI 10.1002/anie.201803026, hdl 1721.1/125726
 )
) - ↑ a et b Bigelow, H. E.; Robinson, D. B., Azobenzene, Org. Synth., coll. « vol. 3 », , p. 103
- ↑ R. F. Nystrom et W. G. Brown, « Reduction of Organic Compounds by Lithium Aluminum Hydride. III. Halides, Quinones, Miscellaneous Nitrogen Compounds », J. Am. Chem. Soc., vol. 70, no 11, , p. 3738–3740 (PMID 18102934, DOI 10.1021/ja01191a057)
- ↑ M. J. Guttieri et W. F. Maier, « Selective cleavage of carbon-nitrogen bonds with platinum », J. Org. Chem., vol. 49, no 16, , p. 2875–2880 (DOI 10.1021/jo00190a006)
- ↑ T. V. (Babu) RajanBabu, Philip C. Bulman Page, Benjamin R. Buckley, "Tri-n-butylstannane" Encyclopedia of Reagents for Organic Synthesis 2004, John Wiley & Sons. doi:10.1002/047084289X.rt181.pub2
- ↑ A. T. Nielsen, « The Isomeric Dinitrocyclohexanes. II. Stereochemistry », J. Org. Chem., vol. 27, no 6, , p. 1998–2001 (DOI 10.1021/jo01053a019)
- ↑ Dauben, Jr., H. J.; Ringold, H. J.; Wade, R. H.; Pearson, D. L.; Anderson, Jr., A. G., Cycloheptanone, Org. Synth., coll. « vol. 4 », , p. 221
- ↑ Senkus, Murray, « Iron Reduction of Some Aliphatic Nitro Compounds », Ind. Eng. Chem., vol. 40, , p. 506 (DOI 10.1021/ie50459a035)
- ↑ A. S. Kende et J. S. Mendoza, « Controlled reduction of nitroalkanes to alkyl hydroxylamines or amines by samarium diiodide », Tetrahedron Letters, vol. 32, no 14, , p. 1699–1702 (DOI 10.1016/S0040-4039(00)74307-3
 )
) - ↑ A. Burger, M. L. Stein and J. B. Clements, « Some Pyridylnitroalkenes, Nitroalkanols, and Alkylamines », J. Org. Chem., vol. 22, no 2, , p. 143–144 (DOI 10.1021/jo01353a010)
- ↑ (en) A. Giannis et K. Sandhoff, « LiBH4(NaBH4)/Me3SiCl, an Unusually Strong and Versatile Reducing Agent », Angewandte Chemie International Edition in English, vol. 28, no 2, , p. 218–220 (DOI 10.1002/anie.198902181)
- ↑ (en) John R. Butterick et A. M. Unrau, « Reduction of β-nitrostyrene with sodium bis-(2-methoxyethoxy)-aluminium dihydride. A convenient route to substituted phenylisopropylamines », J. Chem. Soc., Chem. Commun., no 8, , p. 307–308 (DOI 10.1039/c39740000307)
- ↑ H. Feuer, R. S. Bartlett, B. F. Vincent and R. S. Anderson, « Diborane Reduction of Nitro Salts. A New Synthesis of N-Monosubstituted Hydroxylamines », J. Org. Chem., vol. 30, no 9, , p. 2880–2882 (DOI 10.1021/jo01020a002)
- ↑ (en) P.W.G. Smith et A.R. Tatchell, Aliphatic Nitro Compounds and Amines, Elsevier, , 245–266 p. (ISBN 978-0-08-010746-2, DOI 10.1016/b978-0-08-010746-2.50016-8, lire en ligne)
- ↑ (en) Sean M. Kelly et Bruce H. Lipshutz, « Chemoselective Reductions of Nitroaromatics in Water at Room Temperature », Organic Letters, vol. 16, no 1, , p. 98–101 (ISSN 1523-7060, PMID 24341483, PMCID 4013784, DOI 10.1021/ol403079x)
- ↑ (en) Stéphane Ung, Annie Falguières, Alain Guy et Clotilde Ferroud, « Ultrasonically activated reduction of substituted nitrobenzenes to corresponding N-arylhydroxylamines », Tetrahedron Letters, vol. 46, no 35, , p. 5913–5917 (DOI 10.1016/j.tetlet.2005.06.126, lire en ligne)
- ↑ Braun, V. J. et Sobecki, W., « Über primäre Dinitro-, Nitronitrit- und Dialdoxim-Verbindungen der Fettreihe », Chemische Berichte, vol. 44, no 3, , p. 2526–2534 (DOI 10.1002/cber.19110440377, lire en ligne)
- ↑ J. R. Hanson et E. Premuzic, « Applications of chromous chloride--II : The reduction of some steroidal nitro-compounds », Tetrahedron, vol. 23, no 10, , p. 4105–4110 (DOI 10.1016/S0040-4020(01)97921-9)
- ↑ C. Grundmann, « Über die partielle Reduktion von Nitro-cyclohexan », Angewandte Chemie, vol. 62, nos 23–24, , p. 558–560 (DOI 10.1002/ange.19500622304, Bibcode 1950AngCh..62..558G)
 Portail de la chimie
Portail de la chimie













